Por Meiling Lee
Apesar de ser a única terapia médica ambulatorial autorizada para prevenir o agravamento dos sintomas da COVID-19 em pacientes de alto risco, não resta nenhum fornecimento estável de anticorpos monoclonais pelo governo federal dos EUA, um ano após sua aprovação para uso pelos reguladores médicos.
Lançadas no mesmo mês que as vacinas contra a COVID-19, as terapias com anticorpos monoclonais não receberam a atenção que os tratamentos com vacinas possuem após terem sido anunciadas como o único recurso para tirar a América da pandemia.
Ainda hoje, o presidente Joe Biden continua se concentrando principalmente na vacinação de crianças, fornecendo reforços para todos os adultos e aumentando os testes como parte de suas “novas ações” para combater a pandemia da COVID-19 durante o inverno.
Dr. Marc Siegel, internista praticante e professor de medicina no Langone Medical Center da NYU, afirma que as vacinas por si só não podem tirar os Estados Unidos da pandemia. Mais casos estão sendo descobertos com as variantes Delta e Ômicron, e as hospitalizações estão aumentando neste inverno.
Mais de 206 milhões de americanos estão totalmente vacinados e 72 milhões de pessoas receberam uma dose de reforço até 5 de janeiro. Indivíduos são considerados totalmente vacinados se receberam duas doses das vacinas de RNA mensageiro ou uma única dose da vacina Johnson & Johnson.
Siegel declara que a administração de Biden não conseguiu fornecer nenhuma terapêutica para o tratamento precoce de pessoas com a COVID-19 leve ou moderada devido ao “foco obsessivo da administração na vacinação, excluindo todo o resto”.
“Quando se trata de terapêutica, os resultados da equipe de Biden são ainda mais anêmicos”, escreveu Siegel em um editorial no USA Today. “Paxlovid, o novo medicamento inibidor de protease da Pfizer, foi aprovado, mas é escasso”.
“Idem anticorpos monoclonais, os anticorpos neutralizantes sintéticos que têm sido tão úteis em pacientes com alto risco de complicações ou hospitalizações. A Ômicron é mais suscetível ao sotrovimab, fabricado pela GlaxoSmithKline, mas na maioria dos estados é quase impossível de encontrar”, acrescentou.
O Epoch Times entrou em contato com o governo Biden para comentar.
O Departamento de Saúde e Serviços Humanos dos EUA (HHS) entregou mais de 197.000 tratamentos com anticorpos monoclonais para departamentos de saúde estaduais e territoriais e para entidades federais na semana de 3 de janeiro. O que ocorreu após a agência pausar os tratamentos no dia 23 de dezembro.
Falta de mensagens públicas
As terapias com anticorpos monoclonais demonstraram ser eficazes na prevenção de casos graves da doença ou hospitalização em pacientes de alto risco com a COVID-19 leve a moderada. Eles são diferentes do plasma convalescente de um paciente recuperado da COVID-19, pois os anticorpos monoclonais são “criados [em laboratório] para direcionar especificamente uma parte essencial do processo infeccioso”, segundo médicos do Sistema de Saúde da Universidade de Michigan.
A partir do dia 16 de dezembro de 2021, os Institutos Nacionais de Saúde não recomendam plasma convalescente para o tratamento de pacientes hospitalizados sem imunidade humoral prejudicada.
Os primeiros tratamentos com anticorpos monoclonais receberam autorização de uso emergencial (EUA) em novembro de 2020, mas parecia haver pouco interesse em utilizar a terapia quando o foco estava na campanha para vacinar todas as pessoas com 16 anos ou mais pelos governos estaduais e federal.
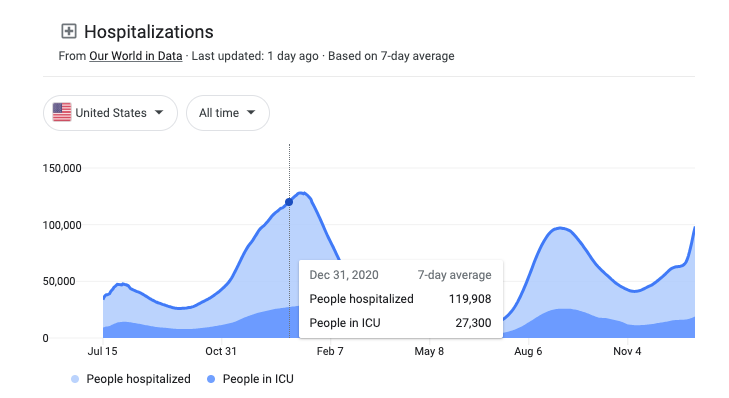
A falta de mensagens sobre os tratamentos com anticorpos monoclonais das autoridades federais fez com que as pessoas não soubessem do curto prazo para receber essas terapias eficazes (dentro de 10 dias após os primeiros sintomas) e que alguns hospitais se recusassem a usá-las. Isso levou a uma baixa demanda por anticorpos monoclonais em um momento em que deveria ter sido utilizado para ajudar a aliviar a tensão nos hospitais, já que os Estados Unidos estavam reportando mais de 100.000 pessoas hospitalizadas por ou com a COVID-19 até o final de dezembro de 2020.
O Dr. Peter McCullough, internista, cardiologista e epidemiologista, afirmou em entrevista ao programa “American Thought Leaders” da da EpochTV, que estava “chocado com a falta de atenção da mídia sobre os anticorpos monoclonais, quase não houve absorção”.
Ele acrescentou: “Ouvimos relatos de que mais de 80% do suprimento estava nas prateleiras. As casas de enfermagem não foram informadas, os cuidados urgentes não tiveram fornecimento, assim como os hospitais não foram fornecidos. Não havia nenhuma mensagem”.
O Epoch Times entrou em contato com o CDC para comentar sobre a falta de mensagens sobre a terapêutica da COVID-19 e foi instruído a entrar em contato com a FDA, que não respondeu até o momento.
Devido à baixa aceitação, o HHS permitiu que os prestadores de serviços de saúde autorizados solicitassem as terapias diretamente do fornecedor de fevereiro de 2021 a 13 de setembro de 2021. Mas o surgimento da variante Delta e a diminuição da eficácia da vacina aumentaram a demanda pelas terapias, levando o HHS a anunciar que voltaria a assumir o controle da distribuição.
O número de anticorpos monoclonais alocados para cada estado e território seria baseado no número de casos, internações e utilizações, um sistema de distribuição que ainda está sendo usado hoje.
No anúncio do dia 13 de setembro, o HHS afirmou que a variante Delta causou um aumento nos usos de terapia de anticorpos monoclonais, “particularmente em áreas do país com baixas taxas de vacinação”, sem maiores esclarecimentos.
Observando as estatísticas do próprio HHS e comparando a taxa de vacinação e os anticorpos monoclonais distribuídos nos 12 estados mais populosos, nem sempre houve uma correlação entre uma baixa taxa de vacinação com maior adesão às terapias.
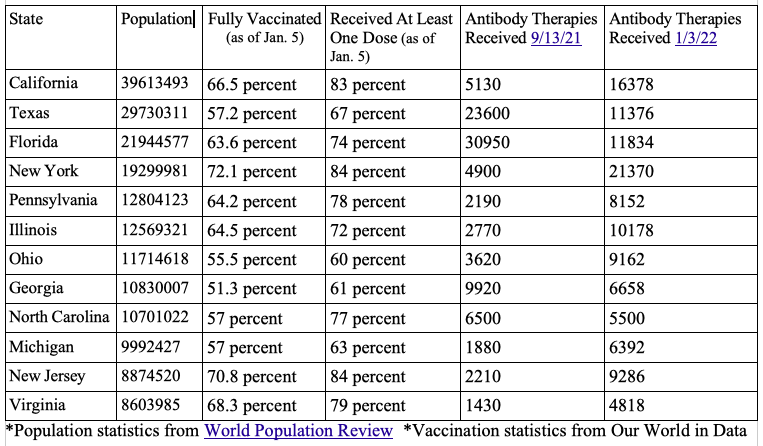
O surgimento da variante Ômicron aumentou ainda mais a confusão sobre se certas terapias de anticorpos deveriam continuar a serem utilizadas e se ainda seriam clinicamente eficazes, particularmente quando o HHS interrompeu a alocação das terapias dois dias antes do Natal.
O HHS emitiu um aviso no dia 23 de dezembro de que interromperia a distribuição das terapias de anticorpos REGEN-COV e Eli Lilly, com base em estudos in vitro ou “tubo de ensaio”– que ainda precisam ser revisados independentemente por pares – que descobriram que os tratamentos com anticorpos podem não ser tão eficazes contra a variante Ômicron, deixando o sotrovimab da GlakoSmithKline como o único tratamento disponível.
O Epoch Times entrou em contato com os dois fabricantes de medicamentos para comentar. Eli Lily não respondeu e a Regeneron nos encaminhou para seu comunicado de imprensa do dia 16 de dezembro (pdf), que afirma: “Embora os anticorpos REGEN-COV atualmente autorizados da Regeneron tenham potência diminuída contra a Ômicron, eles são ativos contra a Delta, que atualmente é a variante prevalente nos EUA”.
A empresa declara que está aguardando aprovação para um ensaio clínico de seus anticorpos monoclonais de “próxima geração” que seriam ativos contra a variante Ômicron e todas as variantes de preocupações.
Eficaz com a Ômicron?
O Cirurgião Geral do Estado da Flórida, Dr. Joseph A. Lapado, afirmou que as descobertas de um estudo realizado em um laboratório não necessariamente concluem o mesmo resultado em humanos.
“Assim, as evidências laboratoriais indicavam que a afinidade dos anticorpos, como os anticorpos Regeneron para a variante Ômicron, estava diminuída… em uma coletiva de imprensa do dia 3 de janeiro.
Ele acrescentou: “Então, há uma diferença entre dados laboratoriais e dados clínicos. E eles tomaram a decisão de reter a medicação com base em dados laboratoriais, mas nos preocupamos com os resultados clínicos. As decisões devem ser baseadas, obviamente, em dados clínicos, e é por isso que eles reverteram [a pausa]”.
O HHS então, suspendeu a pausa oito dias depois, no dia 31 de dezembro, permitindo que todos os estados e territórios continuassem solicitando os tratamentos, citando que “a prevalência de variantes da COVID-19 permanece dinâmica”. A decisão também foi “à luz das recentes diretrizes clínicas do National Institutes of Health (NIH) publicadas no dia 30 de dezembro de 2021 e a variabilidade significativa na prevalência da variante de preocupação Ômicron (VOC)”, acrescentou.
O NIH está recomendando um tratamento de três dias com Remdesivir intravenoso como uma opção de tratamento para pacientes não hospitalizados com a COVID-19 leve a moderado que correm alto risco de doença grave quando a Ômicron é mais de 80% prevalente em uma região.
A recomendação foi baseada no estudo PINETREE, que encontrou uma redução relativa de 87% no risco de hospitalizações e mortes em comparação com o grupo placebo. No entanto, não houve diferença significativa no perfil de segurança de ambos os grupos, pois “eventos adversos ocorreram em 42,3 [por cento] dos pacientes no grupo tratado com Remdesivir e em 46,3 [por cento] daqueles no grupo placebo”.
O Remdesivir é aprovado pela FDA para pacientes que necessitam de hospitalização. Os especialistas recomendam que os médicos realizem “monitoramento renal próximo ao prescrever o Remdesivir” e estejam cientes de que o medicamento pode causar distúrbios renais. Além disso, o NIH afirma que todo paciente deve fazer um teste de função hepática e um teste de tempo de protrombina (para medir o tempo que o sangue leva para coagular) antes de receber o Remdesivir.
Entre para nosso canal do Telegram
Assista também: