Quando as proteínas são aquecidas, suas longas cadeias de moléculas se desenrolam, e isso as incapacita de exercer funções vitais à vida, tais como converter os alimentos em energia ou transportar o oxigênio pelo sangue. Anteriormente, pensava-se que a água era essencial para que as moléculas de proteínas desempenhassem suas funções, e para que enovelassem depois esfriar novamente.
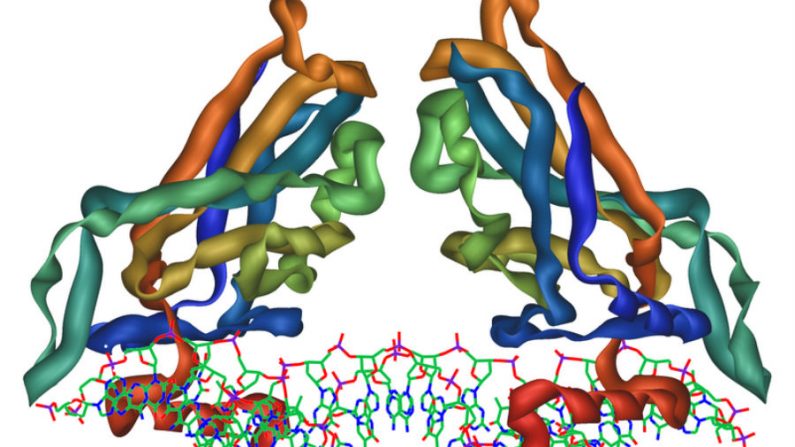
Uma pesquisa da Universidade de Bristol, no Reino Unido, mostrou que a proteína mioglobina, encontrado nas células vermelhas do sangue, pode se enovelar na ausência da água.
“Nossos resultados desafiam o paradigma existente sobre o papel das moléculas de água no enovelamento e nas funções da proteína”, disse o Dr. Adam Perriman da Faculdade de Química da Universidade de Bristol, em um e-mail ao Epoch Times. “É um problema extremamente complexo e envolve virtualmente todos os tipos de ligações químicas, as quais, por sua vez, são todas afetadas pela água.”
O desenrolamento das proteínas é chamado de desnaturação, e ocorre quando elas são aquecidas. Um exemplo típico é ferver um ovo: com o calor, as proteínas do ovo se abrem e se juntam dando solidez ao ovo. No caso das proteínas do ovo, esse processo não pode ser revertido, mas algumas proteínas podem recuperar sua estrutura original quando resfriadas.
Na década de 1990, pesquisadores mostraram que ‘buckyballs’ (carbonos em uma estrutura química semelhante a bolas de futebol) não passam pela fase líquida. Ou seja, “se você aquecer uma amostra seca desse material, ela sublimará na forma de gás. Além disso, se esse gás for resfriado, ele passará diretamente para o estado sólido”, explicou Perriman. “Esse fenômeno, nunca antes observado, ocorre devido às dimensões nanométricas das buckyballs. As proteínas também são de dimensões nanométricas, e por conseguinte, não têm a fase líquida.”
Perriman e seus colegas fizeram uma reengenharia na superfície da molécula de mioglobina, a qual transporta o oxigênio no sangue, utilizando poliméricos tensoativos de modo a dar a essa proteína a capacidade de se derreter. Eles colocaram essa proteína modificada em um ambiente sem qualquer vestígio de moléculas de água.
“Quando percebi que a estrutura da proteína se manteve intacta na ausência de água (ou qualquer solvente), decidi ver se essa proteína poderia se desenrolar quando aquecida e até mesmo voltar a se enovelar quando resfriada”, disse Perriman. “Foi o que ocorreu.”
Os pesquisadores usaram uma técnica chamada de dicroísmo circular para observar como a estrutura dessa mioglobina se modificaria quando aquecida. Eles descobriram que a proteína pode permanecer estável até uma temperatura muito mais elevada que a vista na natureza.
“Em água, a maioria das proteínas se desenrola (desnatura-se) entre 70ºC a 80ºC, no entanto, observamos que ela se desenrolou, num sistema sem solvente, a 155°C”, disse Perriman.
“Essas descobertas poderão ser aplicadas no desenvolvimento de enzimas industriais com alta resistência térmica, onde as condições ambientais sejam severas”, disse Perriman. “Um dos principais resultados é um grande aumento na estabilidade da proteína. Além disso, as proteínas líquidas têm concentrações de proteína extremamente elevadas, o que também pode ser uma vantagem.”
Outras aplicações poderão incluir um curativo inteligente que poderá ser aplicado na forma de aerossol, segundo Perriman. “Os trabalhos estão na fase inicial, mas temos em mente novos trabalhos que envolverão enzimas industriais mais relevantes.”
Os resultados foram publicados online na revista ‘Chemical Science’.